Profesor de Carrera Titular
Correo institucional: gavilan@unam.mx
Tel: +52 5622 5275, 52 5622 5376
Ubicación: Depto de Bioquímica Laboratorio 101 Conjunto E, Facultad de Química.
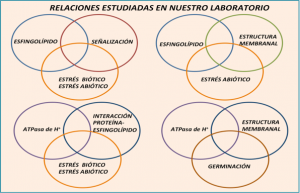
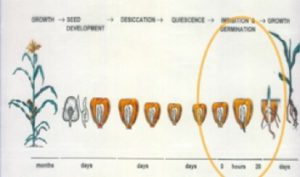
Licenciatura: Biología Facultad de Ciencias UNAM Temas y Lineas de Investigación La membrana plasmática. Es un arreglo supramolecular de lípidos, carbohidratos y proteínas de una gran diversidad estructural que desempeña funciones complejas y vitales para la fisiología celular de las plantas. Los esfingolípidos. Son componentes de la membrana plasmática relativamente nuevos en cuanto a su funcionalidad en plantas. Estudiamos su función señalizadora en vías de transducción que se activan para desencadenar la muerte celular programada como estrategia de defensa contra patógenos biótrofos. Estudiamos también su función en la regulación de la fluidez membranal en el estrés por bajas temperaturas. La ATPasa de H+ de la membrana plasmática. Es una proteína transmembranal que funciona como una bomba de H+ y que es esencial para la vida celular, pues acidifica el medio extracelular para facilitar el transporte de solutos, la transducción de señales, la apertura de estomas y el alargamiento celular. Hemos encontrado que esta enzima es fundamental para el proceso de germinación de maíz, y que su actividad puede estar modulada por el medio lipídico que la rodea. Líneas de Investigación La investigación en nuestro laboratorio se centra en: A) La regulación de la ATPasa de H+ de la membrana plasmática de plantas por el entorno lipídico. B) Las funciones de los esfingolípidos en plantas. Abordamos estas relaciones en tres modelos biológicos: Arabidopsis thaliana, Phaseolus vulgaris (frijol común) y Zea mays (maíz). Los estudios experimentales son abordados en diferentes escenarios fisiológicos como se muestra en los siguientes diagramas. Para ver los proyectos específicos. Proyectos 1.- INTERACCIÓN ENTRE LOS ESFINGOLÍPIDOS Y LAS PROTEÍNAS DE LA MEMBRANA PLASMÁTICA DE PLANTAS Siendo los esfingolípidos especies abundantes en las membranas de las plantas, y en particular en los microdominios membranales, entre otras preguntas, estamos interesados en responder ¿cuál es el impacto de los esfingolípidos en la función catalítica de las proteínas integrales de la membrana plasmática y en particular en la ATPasa de H+, una enzima esencial en la funcionalidad de la célula vegetal? Este aspecto se está abordando tanto en la germinación del maíz como en plantas de Arabidopsis thaliana En colaboración con: Edgar B. Cahoon, Center for Plant Science Innovation & Department of Biochemistry, University of Nebraska-Lincoln, E. U. 2.- ESFINGOLÍPIDOS Y FORMACIÓN DE MICRODOMINIOS MEMBRANALES DE PLANTAS La contribución de los esfingolípidos a la heterogeneidad lateral de las membranas está ampliamente documentada en la literatura de células eucariontes. Ya que las células vegetales están dotadas de una gran diversidad de esfingolípidos, ¿cuáles son sus características estructurales que resultan importantes para constituir los microdominios membranales y cuál puede ser su función en la transducción de las señales emitidas por diversos tipos de estrés? Disponemos de mutantes de Arabidopsis deficientes en varios tipos de esfingolípidos con las que estamos abordando estas y otras preguntas. En colaboración con: 3.- ESFINGOLÍPIDOS Y RESPUESTAS A ESTRÉS BIÓTICO Y ABIÓTICO EN PLANTAS El reciente descubrimiento sobre la capacidad de segundo mensajero de los precursores de esfingolípidos nos ha llevado a formular preguntas como: ¿Cuáles son otros elementos de la vía de transducción mediada por esfingolípidos? ¿Ante qué señales de estrés participan estos esfingolípidos? ¿Cuáles son las características de la muerte celular programada que es ejecutada a través de la señalización por esfingolípidos en la respuesta contra patógenos? Para ello estamos utilizando frijol y Arabidopsis thaliana como modelos y exposición a estrés por patógenos y por frío. En colaboración con: 4.- DINÁMICA Y FUNCIÓN DE LA ACTIVIDAD DE LA ATPASA DE H+ DURANTE EL PROCESO DE GERMINACIÓN. La ATPasa de H+ de la membrana plasmática de plantas es esencial en la vida de la planta en todos sus estadios de desarrollo. Estamos interesados en su participación en el proceso de germinación de la semilla de maíz. Queremos establecer cuál es su contribución en el proceso de elongación radicular y en el de transporte de solutos entre los diversos compartimentos anatómicos de la semilla. En colaboración con: Metodologías Nuestros sistemas experimentales son embriones de maíz (Zea mays), hojas de frijol (Phaseolus vulgaris) y plantas de Arabidopsis thaliana. De esta última especie, disponemos de un número considerable de líneas mutantes. Las formas de estrés que estudiamos son la exposición a patógenos, como forma de estrés biótico y la exposición a bajas temperaturas como forma de estrés abiótico. Evaluamos parámetros fisiológicos y fenotípicos a través de varios indicadores de germinación y de crecimiento, índices fotosintéticos, conductancia estomática, índices de enfermedad, proliferación bacteriana en tejidos vegetales y registro y procesamiento de imágenes. Analizamos ultraestructura celular por técnicas de microscopía electrónica de transmisión, que incluyen tinción negativa y microcortes. Aislamos fracciones citosólicas y microsomales por técnicas de centrifugación diferencial y purificamos membranas plasmáticas y membranas resistentes a la solubilización por detergentes (DRM), por reparto en fases de polímeros acuosos o gradientes de densidad, respectivamente. Determinamos varias actividades enzimáticas por ensayos colorimétricos o isotópicos in vitro o por actividad en gel. Analizamos varios tipos de lípidos por extracciones selectivas y su posterior análisis, enfocándonos en ácidos grasos, esfingolípidos y esteroles por TLC, HPLC y cromatografía de gases acoplada a espectrometría de masas y cromatografía líquida acoplada a espectrometría de masas. Docencia:Formación Académica
Maestria: Bioquímica Facultad de Química UNAM
Doctorado: Bioquímica Facultad de Química UNAM
Postdoctorado: Institute of Molecular Biology, University of Oregon U.S.A.
Estancia sabática: Universidad de California, Riverside. U.S.ADesarrollo Profesional

Diego González Halphen, Instituto de Fisiología Celular, UNAM.
David Díaz Pontones, UAM-Iztapalapa, México.
CONACYT. Facultad de Química, UNAM, México.
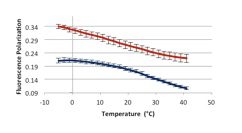
Determinamos fluidez membranal, diferencia transmembranal de pH, potencial de membrana, peroxidación de lípidos membranales y permeabilidad membranal por ensayos fluorescentes, potenciométricos, colorimétricos y de conductimetría, respectivamente.
Determinamos formación de especies reactivas de oxígeno por técnicas colorimétricas y de formación in situ.
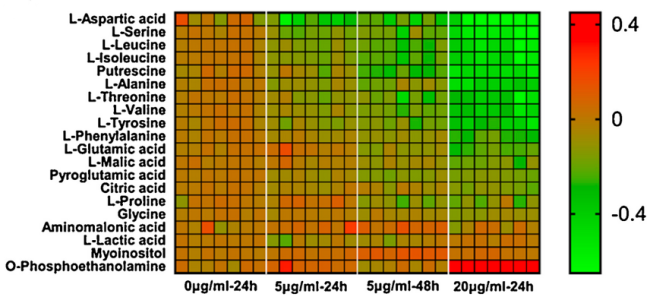
Analizamos proteínas por técnicas electroforéticas (separándolas por pI o por masa molecular), inmunológicas, de biología molecular y de secuenciación de aminoácidos.